Опубликовано 15.01.2026
Современные представления о респираторном микробиоме

Волкова К. Е.1, Сорокин О. В.2, Нефедова Ж. В.3, Панасенко Л. М.3, Суботялов М. А.1,4
1Федеральное государственное бюджетное образовательное учреждение высшего образования «Новосибирский государственный педагогический университет» Министерства просвещения Российской Федерации, Новосибирск, Россия
2ООО «Ведагенетика», Новосибирск, Россия
3Федеральное государственное бюджетное образовательное учреждение высшего образования «Новосибирский государственный медицинский университет» Министерства здравоохранения Российской Федерации, Новосибирск, Россия
4Федеральное государственное автономное образовательное учреждение высшего образования «Новосибирский национальный исследовательский государственный университет» Министерства науки и высшего образования Российской Федерации, Новосибирск, Россия
В статье представлен обзор современных данных о микробиоме дыхательных путей, включая верхние (носовая полость, носоглотка, ротоглотка) и нижние (гортань, трахея, бронхи, легкие) отделы респираторного тракта. Рассмотрены ключевые бактериальные сообщества, их роль в поддержании гомеостаза и влияние на развитие респираторных заболеваний. Особое внимание уделено микобиому (грибковым компонентам, таким как Candida и Aspergillus), вирому (вирусным популяциям), а также археям — новым и малоизученным участникам респираторного микробиома. Статья подчеркивает, что дыхательные пути являются целостной экосистемой, а их микробиом — ключевым фактором здоровья. Дальнейшее изучение взаимодействия всех его компонентов открывает перспективы для разработки новых диагностических и терапевтических стратегий, направленных на коррекцию дисбиоза и восстановление здорового микробного сообщества.
Ключевые слова: респираторный микробиом, нижние дыхательные пути, верхние дыхательные пути, носовые ходы, ротоглотка, носоглотка, трахея, легкие, комменсальные микроорганизмы, патогенные микроорганизмы, археи, дисбиоз, микобиом, виром.
Введение
Совокупность микроорганизмов, обитающих в определенной среде обитания, известна как «микробиом» [1]. Он включает в себя как элементы, влияющие на окружающую среду (иммунные клетки, клеточные протеазы), так и микроорганизмы- обитатели (бактерии, вирусы, грибы, археи, простейшие). Среди всех микробных сообществ человека кишечный микробиом был исследован наиболее подробно [2, 3]. Это связано с тем, что кишечник долгое время считался основным местом обитания микробиома человека. Следовательно, дыхательная система раньше считалась стерильной средой, поскольку традиционные методы идентификации микробиома (посев микробов, иммунологически анализ) в основном опирались на трудоемкие и нечувствительные методы культивирования. В связи с использованием секвенирования 16sРНК, секвенирования методом «дробовика», метаболомики, метапротеомики и высокоскоростного секвенирования (секвенирование «нового поколения» — Next Generation Sequencing) ранее принятая теория была опровергнута. Секвенирование нового поколения выявило сложные сети межмикробных ассоциаций, которые включают в себя истинные мутуалистические, комменсальные и антагонистические прямые или косвенные отношения [1, 4–6]. В настоящее время микробиом дыхательной системы считается достаточно разнообразным и динамичным по своему составу. Последние достижения в области исследований микробиома доказали его значимость для тренировки иммунитета, органогенеза и поддержания иммунной толерантности [4, 7]. Мы находим все больше доказательств существования «окна возможностей» в раннем возрасте, когда адекватная чувствительность к микробиому необходима для созревания иммунитета и последующего здоровья дыхательной системы [4]. Можно предположить, что микробиом дыхательной системы играет ключевую роль в здоровье человека и респираторных заболеваниях и требует дальнейшего изучения [8].
Целью данной статьи является систематизация современных представлений о респираторном микробиоме, включая не только бактериальные сообщества верхних и нижних дыхательных путей, но и менее изученные компоненты: микобиом, виром и археи.
Материалы и методы
Был проведен тщательный обзор литературы, в основном опубликованной в период с 2020 по 2025 год. Мы использовали базу данных PubMed, применяя такие ключевые термины, как «микробиом верхних дыхательных путей», «микробиом нижних дыхательных путей», «микробиом полости рта», «микробиом», «дисбиоз», «виром дыхательных путей», «микобиом дыхательных путей».
Физиологический микробиом респираторного тракта
Современные исследования микробиома дыхательных путей позволили выявить особенности его организации у здоровых людей в различных анатомических отделах. Микробное сообщество респираторного тракта имеет двухкомпонентную структуру, включающую «центральную» и «периферическую» части [9].
Центральный респираторный микробиом (носовая полость, носоглотка, ротоглотка, гортань, верхняя часть трахеи) характеризуется устойчивым присутствием одних и тех же микробных таксонов, метаболических путей и генетических элементов, которые постоянно присутствуют более чем в 95 % взятых образцов у здоровых людей [9].
Периферический микробиом (нижняя часть трахеи, бронхи, бронхиолы, альвеолярная ткань) составляет оставшиеся 5 % от общего микробного пула и отличается высокой динамичностью (рис. 1). Он подвержен быстрым и обратимым изменениям под влиянием физиологических и патологических состояний, поддерживая равновесие за счет механизмов мукоцилиарного клиренса, кашлевого рефлекса и иммунного ответа [7, 9].
Особый интерес представляет формирование респираторного микробиома в раннем онтогенезе. В первый год жизни дыхательные пути богаты родами Moraxella, Streptococcus, Corynebacterium, Staphylococcus, Haemophilus, Alloiococcus и Dolosigranulum, происходящими из микробных сообществ материнского организма (кожные покровы, вагинальная микрофлора, грудное молоко) [10].

Рис. 1. Классификация микробиома дыхательной системы по расположению (Источник: составлено авторами).
С позиций анатомического строения дыхательные пути традиционно подразделяют на верхние (ВДП) и нижние (НДП). Верхние дыхательные пути (носовые ходы, глотка) выполняют важную функцию первичной воздушной фильтрации, находясь в постоянном контакте с внешней средой, что определяет их ключевую роль в формировании микробного гомеостаза и развитии респираторных патологий. Кроме этого, ВДП отвечают за транспортировку воздуха в НДП (гортань, трахея, бронхи, легкие) и обратно [11–13].
Различные сегменты дыхательной системы различаются по физиологическим свойствам: гистологические особенности эпителиальной выстилки, показатели кислотности (рН), микроклиматические условия (температура, влажность), секреторная активность бокаловидных клеток, газовый состав (парциальное давление О2 и СО2). Наиболее экстремальные условия наблюдаются в преддверии носовой полости, где отмечается повышенная кислотность (рН: 5.5–6.5) и соленость (больше, чем в носовой полости, где рН: 7.0–7.5), что создает выраженный селективный барьер для микробной колонизации (микробам сложнее всего закрепиться в этой области). Рядом с ноздрями находится средний носовой ход, который по площади поверхности является самой большой частью носа из-за сложной системы костных раковин. Он содержит бокаловидные клетки, выделяющие муцин, которые отвечают за выработку слизи, выстилающей носовую полость. Оставшаяся часть носовой полости содержит классические реснитчатые псевдостратифицированные и столбчатые эпителиальные клетки, которые способствуют продвижению пахучих веществ и других веществ через носовой проход. В задних отделах полости носа локализованы: клиновидно-решетчатый дренажный комплекс, иммунокомпетентные структуры (носоасоциированная лимфоидная ткань), популяции резидентных макрофагов/дендритных клеток (отвечают за врожденные иммунные функции слизистого барьера носовой полости), пулы Т- и В-лимфоцитов (отвечают за адаптивный компонент иммунной системы носа) [14].
Несмотря на анатомическую целостность дыхательной системы, микробные сообщества демонстрируют выраженную специализацию, обусловленную локальными физико-химическими условиями, механизмами иммунного контроля и особенностями мукоцилиарного транспорта [15]. Так, в этой экологической системе выделяют комменсалов, которые, как считается, способствуют поддержанию эпителиального барьера и патобионтов, которые при определенных обстоятельствах могут быть безвредными или патогенными. Такая дифференциация отражает сложные эволюционно сложившиеся взаимоотношения между макроорганизмом и его микробиомом [12].
Эпителий дыхательных путей выполняет важнейшую барьерную роль, представляя собой сложную многоуровневую систему защиты против патогенных микроорганизмов. Это достигается за счёт двух взаимодополняющих механизмов: механическая защита и структурный (физический) барьер. Механическая защита характеризуется секреторной активностью бокаловидных клеток, продуцирующих мукоидный секрет, содержащий гликопротеины муцины, антимикробные пептиды и секреторные иммуноглобулины; координированной работой реснитчатого аппарата, обеспечивающего эффективную эвакуацию патогенов и направленный транспорт слизи. Физический барьер — это комплекс межклеточных соединений (плотные контакты, адгезивные соединения, щелевые контакты, десмосомы), формирующий непроницаемый барьер, препятствующий проникновению вирусов/бактерий через эпителиальный слой, системному распространению через кровоток и доступу к вирусным рецепторам на базолатеральной поверхности эпителия [12].
Эпителиальные и резидентные сенсорные клетки, включая макрофаги и дендритные клетки, могут распознавать микроорганизмы и реагировать на их присутствие с помощью патоген-распознающих рецепторов (PRR). PRR, экспрессируемые респираторным эпителием, включают Toll-подобные рецепторы (TLR), эпидермальный фактор роста (EGF) и лектины С-типа. PRR распознают консервативные молекулы микроорганизмов (компоненты клеточных стенок бактерий и грибов, флагеллин, вирусные нуклеиновые кислоты), а также компоненты клеток хозяина (маркеры клеточного повреждения — DAMPs), указывающие на повреждение клеток. Активация PRR (распознавание бактериальных, грибковых и вирусных компонентов) инициирует секрецию медиаторов (провоспалительных цитокинов, хемокинов, интерферонов I типа), которые запускают врождённый иммунный ответ. Например, модулирование межклеточных соединений посредством повышения уровня провоспалительных цитокинов или эпидермального фактора роста, что может привести к ослаблению/усилению респираторного эпителиального барьера соответственно [14, 16]. Цитокины могут локально воздействовать на эпителиальные клетки, повышая экспрессию генов, которые способствуют уничтожению патогенов (например, гены, отвечающие за выработку слизи, противомикробных пептидов и интерферонов). Цитокины и хемокины также активируют и привлекают иммунные клетки, которые выполняют ряд контрольных функций, в том числе фагоцитоз и воспаление. Интерфероны особенно важны для борьбы с вирусами, поскольку они сигнализируют окружающим клеткам о наличии вирусной инфекции и активируют гены, ограничивающие репликацию вируса. Эти врождённые иммунные реакции помогают защититься от патогенных микроорганизмов, однако реакция на комменсальные и патогенные микроорганизмы значительно различается. Это позволяет микробиому дыхательных путей колонизировать эпителий, не вызывая хронического воспалительного иммунного ответа [12].
Микробиом верхних дыхательных путей (вдп)
ВДП представляют собой сложную экосистему, заселенную разнообразными микробными сообществами, состав которых существенно варьирует в зависимости от анатомо-физиологических особенностей различных отделов (рис. 2). Преддверие носовой полости расположено ближе всего к внешней среде. Оно выстлано кератинизированным плоским эпителием, содержит сальные железы, продуцирующие липидные компоненты и кожное сало (себум) и характеризуется кожным типом микробиома. Носовые пазухи и носоглотка покрыты псевдостратифицированным столбчатым и реснитчатым эпителием, который вырабатывает слизь и формирует слизистый тип микробиоценоза [12].
Резидентные микроорганизмы выполняют важные защитные функции, однако при определенных условиях способны проявлять патогенные свойства. Микроорганизмы, являющиеся потенциальными патогенами, могут стать возбудителями местных и системных инфекций. Такая трансформация может быть обусловлена факторами микробной вирулентности (адгезивная способность, продукция экзотоксинов, формирование биопленок), факторами хозяина (нарушение мукоцилиарного клиренса, снижение местного иммунитета, эпителиальные повреждения), экзогенными воздействиями (антибиотикотерапия, коинфекции). Механизмами патогенной трансформации служат: микробный дисбиоз, проявляющийся в изменении количественных соотношений, появление атипичных штаммов, нарушение колонизационной резистентности, активация условно-патогенных свойств у комменсалов [17].
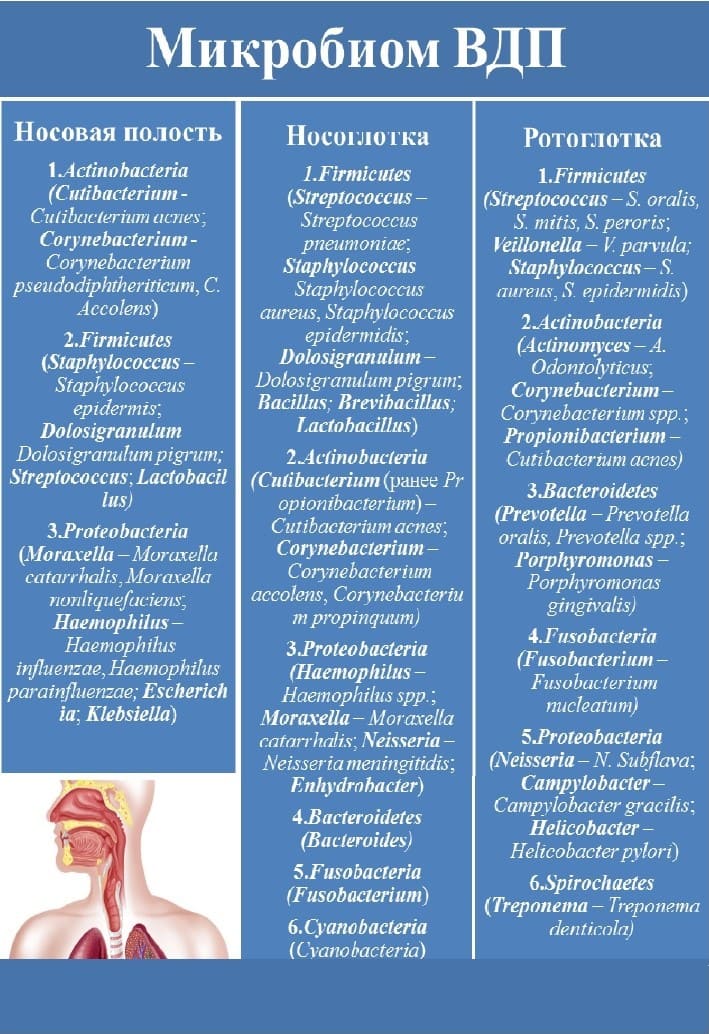
Рис. 2. Разнообразие микробиома верхних дыхательных путей (Источник: составлено авторами).
Кроме этого, в ВДП обитают транзиторные микроорганизмы, которые препятствуют разрастанию и распространению потенциальных патогенов в направлении лёгких, выступая в качестве защитников здоровья дыхательных путей посредством различных механизмов устойчивости к колонизации (выработка противомикробных пептидов, заполнение ниш и восполнение питательных веществ, мукоцилиарный и иммунный клиренс, изменение физиологии микробов) [4].
Исследование передних носовых ходов, среднего носового хода и клиновидной пазухи у здоровых взрослых добровольцев выявило наличие различных микробных сообществ в каждом из этих участков. Было обнаружено, что передние отделы носовых ходов характеризуются сниженным альфа-разнообразием, в котором доминируют Cutibacterium (ранее Propionibacterium), Corynebacterium spp., Staphylococcus spp. (Staphylococcus aureus) [14].
Напротив, в среднем носовом ходе и клиновидно-этмоидальной области наблюдались схожие микробные сообщества с точки зрения видового разнообразия и равномерности, которые содержали больше Proteobacteria, чем передние носовые ходы [12, 14, 17].
Среди типов бактерий, присутствующих во всех типичных местах в носовой полости, наиболее распространёнными являются Actinobacteria (преобладающие роды — Corynebacterium и Cutibacterium), которые являются универсальными обитателями всех возрастных групп. Важно отметить, что чаще всего Actinobacteria ассоциированы с повышенной стабильностью микробиома, снижением риска респираторных инфекций и связанных с ними осложнений (особенно в раннем возрасте). После Actinobacteria, Firmicutes обычно являются вторым по численности типом микроорганизмов в составе микробиома носа. Как и предполагалось в исследованиях, основанных на изучении микробиома, некоторые виды Firmicutes более приспособлены к выживанию в носовой полости, чем другие, в частности, роды Staphylococcus, Streptococcus и Dolosigranulum. Например, комменсальный вид Staphylococcus epidermidis колонизирует почти 100 % людей в раннем возрасте, сохраняется в полости носа на прилегающей коже и связан со стабильным носовым микробиомом. Наконец, такие роды Proteobacteria, как Moraxella и Haemophilus, могут колонизировать носовую полость на уровне, аналогичном уровню Actinobacteria и Firmicutes в раннем детстве, но затем, по мере взросления, их количество снижается. В то время как комменсальные бактерии составляют подавляющее большинство бактерий, присутствующих в носовой полости (более 90 %), исследования микробиома, основанные на культивировании и независимом микробиоме, показывают, что условно-патогенные микроорганизмы, которые могут действовать как в качестве патогенов, так и в качестве комменсалов, менее распространены в носовой полости [14].
Носоглоточный микробиом представляет собой высокодинамичную и наиболее разнообразную экосистему отделов верхних дыхательных путей, существенно превосходя по видовому богатству микробные сообщества носовых пазух [10, 18]. В основном носоглотка выстлана многослойным плоским эпителием, однако есть участки, где многослойный эпителий чередуется с островками реснитчатого эпителия.
Микробиом носоглотки называют диагностическим окном в борьбе с респираторными инфекциями и устойчивостью к противомикробным препаратам. В состав входят комменсальные виды (Streptococcus spp., Cutibacterium (бывш. Propionibacterium) — Propionibacterium acnes, Corynebacterium — Corynebacterium accolens и Corynebacterium propinquum, Dolosigranulum — Dolosigranulum pigrum, Haemophilus spp., Moraxella catarrhalis, Neisseria meningitidis) и условные патогенные (Streptococcus pneumoniae, Staphylococcus aureus, S. Epidermidis, P. acnes) [1, 5, 13, 19, 20].
У здоровых детей наблюдается последовательная смена доминирующих таксонов. В возрасте 1 года наблюдается ранний рост Streptococcus spp., который в дальнейшем дополняется Corynebacterium, Dolosigranulum и только через 2–3 месяца Moraxella. В 18 месяцев Streptococcus spp. заменяется на Enhydrobacter в 50 % случаев. У детей с повышенной частотой инфекций дыхательных путей (ИДП) наблюдается обратная картина. Moraxella у них преобладает значительно раньше, чем Corynebacterium, Dolosigranulum. У недоношенных детей наблюдается уменьшение численности Corynebacterium и Alloiococcus [20].
Интересно, что Proteobacteria, Fusobacteria, Cyanobacteria в зависимости от сезона года изменяются в численности. Пик наблюдается осенью/зимой, который исчезает к весне, способствуя временному росту Bacillus, Brevibacillus, Lactobacillus и Bacteroidetes. Однако в микробиоме носоглотки такой существенной разницы в зависимости от сезона не наблюдается [10].
D. pigrum демонстрирует симбиотические отношения с Corynebacterium spp. через продукцию молочной кислоты, которая создает низкое рН, благоприятное для роста Corynebacterium spp. Было высказано предположение, что Dolosigranulum и Corynebacterium spp. являются ключевыми видами носоглотки благодаря своей связи со здоровьем респираторной системы и устойчивостью к S. pneumoniae [10].
Важно понимать, что микробиом носоглотки выполняет двойственную роль. С одной стороны, он может быть потенциальным источником патогенов, попадающих в легкие и способствующих развитию респираторных заболеваний. С другой стороны, он является важным диагностическим маркером состояния респираторного микробиома в целом. В связи с этим, поддержание баланса между комменсалами и условными патогенами в носоглотке представляет ключевую стратегию профилактики дисбиотических нарушений во всей дыхательной системе [10].
Микробиом полости рта и глотки более разнообразен, чем микробиом носоглотки. В полости рта есть как твердые, так и мягкие анатомические структуры, такие как зубы, десневая борозда, прикрепленная десна, язык, внутренняя поверхность щек и нёбо. Сложная анатомическая организация этой области создает множество экологических ниш для различных микробных сообществ. Согласно современным данным, микробиом ротовой полости человека включает свыше 700 видов бактерий, поэтому на данный момент он считается вторым по величине в организме человека, уступая только кишечнику [18, 21, 22]. Доминирующими симбионтами принято считать Streptococcus (S. oralis, S. mitis, S. peroris), Actinomyces, Corynebacterium; после них идут Prevotella, Fusobacterium, Veillonella, Neisseria, Staphylococcus, Propionibacterium. Патогенные виды представлены Porphyromonas gingivalis, Treponema denticola, Campylobacter gracilis, Fusobacterium nucleatum, Prevotella oralis [11, 20]. Н. pylori быстро развивается как отдельная ниша в ротовой полости, что связано, скорее всего, со стимуляцией защитного механизма, направленного на увеличение общего микробного разнообразия [23].
Слюна и жидкость десневых щелей обеспечивает теплую (примерно 37 ℃) и влажную среду (влажность 98–99 %), а также питательные вещества, полученные от хозяина (ферменты, минеральные компоненты, гликопротеины) для развития микрофлоры. Слюна содержит не только питательные вещества для роста микроорганизмов, но и противомикробные компоненты (лизоцим, лактоферрин, иммуноглобулины), подавляющие рост микроорганизмов, не обитающих в полости рта. Симбиоз иммунной реакции организма и микробов полости рта предотвращает острую инфекцию слизистой оболочки полости рта, несмотря на плотное и разнообразное заселение микрофлорой [21].
Образование биопленок представляет собой стратегический механизм выживания микробных популяций в полости рта, обеспечивающий их физическую защиту и функциональную стабильность. Данный процесс играет центральную роль не только в колонизации зубных поверхностей и десен, но и в патогенезе респираторных инфекций. Биопленки служат основным фактором персистенции, хронизации и диссеминации инфекционных агентов в дыхательных путях, обусловливая резистентность к антимикробной терапии и склонность к рецидивам. Критически важным аспектом является пространственная и метаболическая гетерогенность биопленок в различных биотопах полости рта. Наддесневые биопленки характеризуются стратифицированной структурой с преобладанием анаэробных и факультативно-анаэробных видов (например, Streptococcus mutans, Actinomyces spp.), которые формируют многослойные матриксные образования. В противоположность этому, поддесневые биопленки отличаются наличием строгих анаэробов (Porphyromonas gingivalis, Treponema denticola) и сложными симбиотическими взаимоотношениями (кросс-фединг, горизонтальный перенос генов). Указанные структурно-функциональные особенности оральных биопленок обуславливают их роль в качестве резервуара респираторных патогенов. Межвидовая коагрегация, например, между Fusobacterium nucleatum и Staphylococcus aureus, способствует адгезии и инвазии последнего в нижние дыхательные пути. Кроме того, биопленочный образ жизни усиливает вирулентный потенциал микроорганизмов посредством регуляции кворум-сенсинга и экспрессии генов патогенности. Таким образом, полимикробные биопленки полости рта не только выступают в качестве первичного очага колонизации, но и функционируют как платформа для адаптации, эволюции и распространения респираторных патогенов, существенно отягощая течение и терапию связанных с ними заболеваний [11, 30].
Топографическое различие между носоглоткой и ротоглоткой, наблюдаемое у людей среднего возраста, исчезает у пожилых людей. Такая утрата различий между микрофлорой полости рта и микрофлорой носоглотки, вызванная или связанная с проникновением таксонов из ротоглотки в носоглотку, предшествует инфекциям дыхательных путей и способствует повышенной восприимчивости к заболеваниям у этой группы населения [10, 21, 24]. Дисбиоз полости рта также увеличивает количество вирулентных и воспалительных микробов, вызывая проникновение микробов в дыхательные пути и легкие [21].
Следовательно, ротоглоточный микробиом представляет собой сложную экосистему, нарушения которой могут иметь значительные последствия для респираторного здоровья, особенно в уязвимых группах населения.
Микробиом нижних дыхательных путей (ндп)
Исследование легочного микробиома остается относительно новым направлением в сравнении с изучением других микробных экосистем организма. Дыхательная система обладает комплексными механизмами устранения микроорганизмов, включающими: мукоцилиарный транспорт, кашлевой рефлекс, врожденный и адаптивный иммунитет, антимикробные свойства сурфактанта (дистальные альвеолы погружены в альвеолярный сурфактант, который также обладает ингибирующей активностью в отношении некоторых штаммов бактерий). Эти факторы формируют строгие условия отбора, приводящие к формированию относительно бедного микробного сообщества в дистальных отделах респираторного тракта [25].
У взрослого человека в стабильном состоянии легочный микробиом схож с микробиомом ротоглотки (Prevotella и Veillonellа), а у детей с микробиомом носоглотки. Интересно, что у тех людей, у которых был обнаружен «ротоглоточный» микробиом лёгких, наблюдался особый метаболический профиль, характеризующийся смещением иммунного профиля в сторону Th17 и ослабленной реакцией альвеолярных макрофагов на стимуляцию TLR4. Эти результаты были воспроизведены на мышиных моделях, показавших, что однократное аспирирование смесью микроорганизмов, обитающих в ротовой полости человека (Prevotella melaninogenica, Veillonella parvula, Streptococcus mitis), вызывает устойчивый Th17- ответ и регуляторный иммунный ответ, тем самым обеспечивая защиту от инфекции S. Pneumoniae. Однако, несмотря на схожесть состава в этих двух областях (ротоглотка и легкие), пропорции популяций микробов отличаются. Так, микробиом легких содержит другие пропорции Ralstonia, Bosea, Haemophilus, Enterobacteriaceae и Methylobacterium по сравнению с микробиомом ротоглотки [25].
Постоянный приток микробов, даже если он сильно варьируется в стабильном состоянии, вызывает слабовыраженные воспалительные реакции, которые важны для поддержания гомеостаза и уничтожения патогенных бактерий. Это явление можно назвать иммунологическим фоном дыхательных путей [27, 28]. Несмотря на неопределенность в отношении определения основного состава «здорового» микробиома легких, основной микробиом легких включает Pseudomonas, Streptococcus, Proteus, Clostridium, Haemophilus, Veillonella и Porphyromonas. При этом, в верхних отделах легких преобладают Actinobacteria и Firmicutes, в нижних Proteobacteria и Bacteroidetes [27]. У здоровых детей и взрослых в микробиоме легких было обнаружено множество бактерий, характерных для ВДП, включая Firmicutes (Staphylococcus, Streptococcus и Veillonella spp.), Bacteriodetes (Prevotella spp.) и Proteobacteria (Porphyromonas, Moraxella и Haemophilus spp.). Большая часть флоры является аэробной, за исключением Clostridium, Veillonella и Porphyromonas, которые являются специализированными анаэробами [4, 25].
Микобиом легких у здоровых людей включает в себя Cladosporium cladosporioides и Eremothecium sinecaudum, а основными патогенными грибками, поражающими легкие у людей с респираторными заболеваниями, являются Candida albicans, Aspergillus spp. и Penicillium spp. Род Malassezia чрезмерно распространён у пациентов с астмой [11].
Исследования показали, что состав микробиома легких непостоянен и динамически меняется в зависимости от иммунного ответа организма и миграционных движений ВДП. Следовательно, в отличие от таких участков, как кожа и кишечник, которые имеют устойчивый и самоподдерживающийся микробиом, микробиом лёгких может мигрировать из соседних участков (носоглотка, ротоглотка). Непрерывная миграция микроорганизмов между этими участками означает, что микробиом лёгких находится в постоянном движении [25].
Микобиом и виром дыхательной системы
Вирусы (виром) и грибы (микобиом) также являются частью микробиома дыхательной системы. Исследование вирома сталкивается с существенными методологическими сложностями, обусловленными отсутствием универсальных генетических маркеров (аналогов бактериальных 16S рРНК) и высокой степенью генетической вариабельности вирусов. Современные исследования опираются на технологии высокопроизводительного секвенирования (NGS), которые позволяют выявить количественное распределение, таксономический состав и функциональные особенности человеческого вирома. У людей количество вирусных частиц различается в зависимости от части тела. Например, в содержимом кишечника содержится 109 частиц/г вируса, а в ротоглотке, носовой полости, глотке и слюне — 108 частиц/мл [25].
Виром здорового человека представлен тремя основными семействами: Paramyxoviridae, Picornaviridae и Orthomyxoviridae. Papillomaviridae, Polyomaviridae, Adenoviridae являются менее распространенными представителями. Недавно список представителей вирома пополнило семейство Redondoviridae. Многочисленные исследования показывают, что у здоровых людей вирусное сообщество менее сложное и разнообразное, чем у лиц с хроническими респираторными заболеваниями [25].
Виром в здоровом лёгком функционирует иначе, чем в больном. Латентные вирусные инфекции могут быть полезны для хозяина, поскольку они модулируют иммунный ответ за счет поддержания базового уровня IFN-y, активации макрофагальной системы, формирования перекрестной защиты. Например, мыши, латентно инфицированные вирусом герпеса, устойчивы к заражению Listeria monocytogenes. На данный момент большинство исследований направлено на изучение ДНК-вирусов, а не РНК-вирусов. Следовательно, изучение респираторного вирома еще не завершено и будущие исследования могут быть сосредоточены на взаимодействии вирусов с другими микроорганизмами респираторного микробиома. Это может стать началом понимания механизма развития заболеваний [25].
Грибковое сообщество (микобиом), хотя и составляет незначительную долю общего микробиома, играет важную роль в поддержании респираторного гомеостаза. В кладистике грибы обычно подразделяют на восемь типов, двенадцать подтипов и несколько классов [26]. Размер микобиома дыхательных путей на данный момент неизвестен, микобиомы кишечника и кожи составляют примерно 0,1 % и 3,9 % соответственно от общего микробиома. Для анализа грибковых инфекций обычно используется целевое секвенирование внутренних транскрибируемых спейсеров или генов 18s рРНК, а также полногеномное секвенирование [25].
В отличие от бактерий, непосредственно регулирующих легочную среду и иммунный ответ, микобиом легких функционирует как значимый кофактор в модуляции иммунного ответа хозяина и воспалительных процессов. Грибковые микроорганизмы оказывают многогранное влияние: участвуют в поддержании физиологического гомеостаза респираторного тракта, но при определенных условиях способствуют снижению легочной функции и прогрессированию хронических заболеваний. Ключевым аспектом является способность грибов опосредованно влиять на бактериальный компонент микробиома через межвидовые взаимодействия, включая как синергические отношения (коагрегация, усиление колонизационного потенциала), так и антагонистические эффекты (конкуренция за питательные субстраты и экологические ниши). В частности, грибы и бактерии могут формировать смешанные биопленки, что приводит к появлению полимикробных сообществ с повышенной устойчивостью к противомикробным препаратам и усиленным патогенным потенциалом. Хотя грибы традиционно рассматриваются как потенциальные патогены, в большинстве случаев они выполняют симбиотическую роль в респираторной экосистеме. Основным механизмом проникновения грибковых элементов из верхних дыхательных путей в нижние является микроаспирация содержимого ротоглотки, что подчеркивает тесную анатомо-функциональную связь между микробными сообществами различных отделов респираторной системы и их роль в поддержании или нарушении респираторного здоровья [25].
В здоровом организме человека микобиом представлен преимущественно тремя отделами: Ascomycota, Basidiomycota и Zygomycota. Наиболее распространенными родами в полости рта и носа являются Candida (встречаемость 75 %), Cladosporium (65 %), Aspergillus (35 %), Fusarium (30 %), а также Saccharomyces, Penicillium, Alternaria и Cryptococcus. Дополнительные исследования выявили присутствие других таксонов, включая Malassezia, Eurotium, Pneumocystis и представителей семейства Davidiellaceae. Данные исследований свидетельствуют о значительном таксономическом разнообразии грибковой микрофлоры респираторного тракта, где доминирующее положение занимают представители рода Candida и родственные таксоны. При этом важно отметить, что состав микобиома демонстрирует вариабельность между различными биотопами дыхательной системы и индивидуальные особенности у здоровых людей [25, 26].
В работе Ward и соавт. был проведен анализ микробной колонизации у младенцев первого месяца жизни, включая оценку орального микобиома и вагинального микобиома матерей, с целью определения влияния способа родоразрешения на процесс колонизации. В целом, в микобиоме младенцев, по-видимому, доминирует ограниченное количество таксонов, включая представителей родов Candida (с видами C. parapsilosis, C. tropicalis, C. Orthopsilosis и C. albicans), Saccharomyces (с видом S. cerevisiae) и Cladosporium (с видом C. velox) [26, 31]. Долгое время считалось, что представители рода Candida доминируют в микобиоме полости рта. Ghannoum и его коллеги описали микобиом полости рта у здоровых людей. Они выявили 101 вид грибов у здоровых взрослых, что свидетельствует о более высоком разнообразии данных микроорганизмов [26, 32].
Микобиом ВДП и НДП отличается по своему составу. Так, в легких отмечается присутствие Cryptococcus, которые отсутствуют в микобиоме ротовой полости. В патологических состояниях микобиом может подвергаться количественным и качественным изменениям, характерным для конкретного заболевания (этому также может способствовать грибковый дисбиоз кишечника) [4].
Таким образом, вирусный и грибковый компоненты представляют собой важные, хотя и менее изученные элементы респираторного микробиома, требующие дальнейших комплексных исследований. Они открывают новые перспективы в понимании патогенеза респираторных заболеваний и разработке инновационных подходов к их лечению [25, 26].
Археи как малоизученный представитель респираторного микробиома
Археи представляют собой отдельный домен живых организмов, выделенный на основании молекулярно-филогенетических данных. Несмотря на сходство с бактериями (прокариотическое строение клетки), археи обладают уникальными чертами: особой структурой мембран, включающих липиды на основе глицерол-1- фосфата, и исключительной способностью к метаногенезу — биологическому производству метана, не свойственному другим организмам. Примечательно, что археи демонстрируют эволюционный синтез признаков разных доменов: их аппарат репликации ДНК и транскрипции генов сходен с эукариотным (например, структура РНК-полимеразы), в то время как метаболические пути и отсутствие ядра роднят их с бактериями. Эта двойственная природа подчеркивает уникальное положение архей в системе органического мира и их особую роль в эволюции жизни [4].
Несмотря на подтверждённое присутствие архей в микробиоме человека, большинство исследований по-прежнему сосредоточено на бактериях, вирусах и грибах. Во многих работах установлен порог обнаружения (<1 %) для исключения потенциальных загрязнений, что часто ведет к исключению архей из анализа из-за их низкой численности. Такой подход может искусственно обеднять представления о разнообразии микробиома и привести к недооценке роли малочисленных организмов в развитии дисбиоза и патологических процессов. Совершенствование молекулярных методов, в частности — разработка специфических праймеров для амплификации архейной ДНК и применение высокочувствительных технологий секвенирования (NGS), позволяет преодолеть эти ограничения. Эти подходы обеспечивают обнаружение ранее не идентифицированных компонентов микробиома, включая архей, что критически важно для формирования целостного понимания структуры и функций микробного сообщества человека [26].
На самом деле, сложно продемонстрировать или доказать точную физиологическую или патологическую роль архей в микробиоме человека из-за трудностей с их выращиванием в обычных микробиологических лабораториях и культурах. Поэтому в этой области всё ещё существует большой пробел в знаниях. На данный момент существование архей в микробиоме человека было доказано в некоторых областях человеческого тела, где, по-видимому, доминируют метаноархеи [26].
В целом, представителей филогенетических типов архей можно обнаружить в нескольких местах человеческого тела, а именно: кожные покровы, желудочно- кишечный тракт, носовая полость и ротовая полость (зубной налет). Прежде всего, в ротовой полости человека часто обнаруживаются представители метаноархей, в первую очередь Methanobrevibacter oralis, Methanobrevibacter smithii, Methanosarcina mazeii и Methanobacterium curvum [29].
Работа Koskinen и его коллег впервые систематизировала данные об археоме человека, в том числе об археоме человеческого носа [26]. Результаты показали картину дифференциации ниш в сообществах археев, связанных с человеком, и, в частности, в образцах из носа часто обнаруживались Euryarchaeota и Thaumarchaeota, связанные с кожей. Кроме того, авторы охарактеризовали назальный микробиом добровольцев с нормальным и пониженным обонянием, чтобы проанализировать взаимосвязь между назальным микробиомом и обонятельной функцией у людей. Было обнаружено, что микробиомы людей с нормальным и пониженным обонянием различаются по степени избыточности и α- разнообразию [33].
Результаты изучения материала показали, что археи представляют собой малоизученный, но потенциально значимый компонент человеческого микробиома, требующий дальнейших комплексных исследований.
Заключение
Современные исследования позволяют сделать важные выводы о микробиоме дыхательных путей у здоровых людей. Дыхательная система представляет собой сложную экосистему с четким распределением микроорганизмов по отделам. ВДП (носовая полость, носоглотка, ротоглотка) имеют стабильный микробный состав с преобладанием комменсальных бактерий — Corynebacterium, Streptococcus, Dolosigranulum. Эти микроорганизмы формируют устойчивые сообщества, которые обнаруживаются у 95 % здоровых людей. НДП (трахея, бронхи, легкие) отличаются меньшим разнообразием микробов и большей изменчивостью состава, здесь преобладают Pseudomonas, Haemophilus и Prevotella.
Формирование микробиома начинается с рождения, когда ребенок получает первые микроорганизмы от матери. В течение первых лет жизни состав микробного сообщества постепенно усложняется и стабилизируется, достигая зрелого состояния к 3–5 годам. Каждый отдел дыхательной системы создает особые условия для жизни микробов. Например, в передних отделах носа, где среда более кислая и соленая, живут преимущественно кожные бактерии. В средних носовых ходах и носоглотке условия другие, поэтому там поселяются другие виды микроорганизмов.
Особое значение имеет баланс между полезными и потенциально опасными микробами в носоглотке. Этот баланс поддерживается сложной системой взаимодействий между разными микроорганизмами, клетками дыхательных путей и иммунной системой. Кроме бактерий, в дыхательных путях живут грибы (Candida, Aspergillus), вирусы и даже археи — особая группа микроорганизмов, похожих на бактерий. Все вместе они образуют сложную экосистему, которая защищает наши дыхательные пути от опасных инфекций.
Когда этот тонкий баланс нарушается (это называется дисбиоз), могут развиваться различные заболевания. Поэтому изучение микробиома дыхательных путей открывает новые возможности для профилактики и лечения болезней органов дыхания. В будущем это может привести к созданию новых методов лечения, основанных на восстановлении нормального состава микроорганизмов в дыхательных путях. Особенно перспективными направлениями являются изучение роли грибов и вирусов в поддержании здоровья, исследование малоизученных архей, а также разработка персонализированных подходов к коррекции микробного состава у конкретных пациентов. Таким образом, микробиом дыхательных путей — это сложная и хорошо организованная система, правильная работа которой крайне важна для нашего здоровья.
Список литературы
- Valverde-Molina J. Microbiome and Asthma: Microbial Dysbiosis and the Origins, Phenotypes, Persistence, and Severity of Asthma / J. Valverde-Molina, L. García-Marcos // Nutrients. – 2023. – Vol. 15, No 3. – P. 486.
- Dogra S. Rate of establishing the gut microbiota in infancy has consequences for future health / S. Dogra, O. Sakwinska, S. E. Soh [et al.] // Gut Microbes. – 2015. – Vol. 6. – P. 321–325.
- Guo M. Y. The Role of Respiratory Flora in the Pathogenesis of Chronic Respiratory Diseases / M. Y. Guo, H. K. Chen, H. Z. Ying, F. S. Qiu, J. Q. Wu // Biomed Research International. – 2021. – Vol. 2021. – P. 6431862.
- Garaci E. Bacteria and fungi of the lung: allies or enemies? / E. Garaci, M. Pariano, E. Nunzi [et al.] // Frontiers in Pharmacology. – 2024. – Vol. 15. – P. 1497173.
- Losol P. The Role of Upper Airway Microbiome in the Development of Adult Asthma / P. Losol, J. P. Choi, S. H. Kim [et al.] // Immune Network. – 2021. – Vol. 21, No 3. – P. e19.
- Shah R. The airway microbiome and pediatric asthma / R. Shah, S. Bunyavanich // Current Opinion in Pediatrics. – 2021. – Vol. 33, No 6. – P. 639–647.
- Crestez A. M. Oral Cavity Microbiome Impact on Respiratory Infections Among Children / A. M. Crestez, A. Nechita, M. P. Daineanu [et al.] // Pediatric Health, Medicine and Therapeutics. – 2024. – Vol. 15. – P. 311–323.
- Álvarez-Santacruz C. The Microbiota in Long COVID / C. Álvarez-Santacruz, S. D. Tyrkalska, S. Candel // International Journal of Molecular Sciences. – 2024. – Vol. 25, No 2. – P. 1330.
- Dickson R. P. Bacterial Topography of the Healthy Human Lower Respiratory Tract / R. P. Dickson, J. R. Erb-Downward, C. M. Freeman [et al.] // mBio. – 2017. – Vol. 8, No 1. – P. e02287-16.
- Flynn M. The microbiome of the nasopharynx / M. Flynn, J. Dooley // Journal of Medical Microbiology. – 2021. – Vol. 70, No 6. – P. 001368.
- 11. Zhao L. The Human Respiratory Microbiome: Current Understandings and Future Directions / L. Zhao, J. L. Luo, M. K. Ali [et al.] // American Journal of Respiratory Cell and Molecular Biology. – 2023. – Vol. 68, No 3. – P. 245–255.
- Nesbitt H. Manipulation of the Upper Respiratory Microbiota to Reduce Incidence and Severity of Upper Respiratory Viral Infections: A Literature Review / H. Nesbitt, C. Burke, M. Haghi // Frontiers in Microbiology. – 2021. – Vol. 12. – P. 713703.
- Losol P. Association of upper airway bacterial microbiota and asthma: systematic review / P. Losol, H. S. Park, W. J. Song [et al.] // Asia Pacific Allergy. – 2022. – Vol. 12, No 3. – P. e32.
- Hardy B. L. Friend or Foe: Interbacterial Competition in the Nasal Cavity / B. L. Hardy, D. S. Merrell // Journal of Bacteriology. – 2021. – Vol. 203, No 5. – P. e00480-20.
- van Beveren G. J. The respiratory microbiome in childhood asthma / G. J. van Beveren, H. Said, M. A. van Houten [et al.] // Journal of Allergy and Clinical Immunology. – 2023. – Vol. 152, No 6. – P. 1352–1360.
- Nesbitt H. Manipulation of the Upper Respiratory Microbiota to Reduce Incidence and Severity of Upper Respiratory Viral Infections: A Literature Review / H. Nesbitt, C. Burke, M. Haghi // Frontiers in Microbiology. – 2021. – Vol. 12. – P. 713703.
- Korkmaz H. Effect of Antibiotic Exposure on Upper Respiratory Tract Bacterial Flora / H. Korkmaz, Y. Çetinkol, M. Korkmaz [et al.] // Medical Science Monitor. – 2022. – Vol. 28. – P. e934931.
- Crestez A. M. Oral Cavity Microbiome Impact on Respiratory Infections Among Children / A. M. Crestez, A. Nechita, M. P. Daineanu [et al.] // Pediatric Health, Medicine and Therapeutics. – 2024. – Vol. 15. – P. 311–323.
- Peace O. Respiratory and Neurological Disease across Different Ethnic Groups Is Influenced by the Microbiome / O. Peace, K. Rachakonda, M. Kress [et al.] // Microorganisms. – 2021. – Vol. 9, No 9. – P. 1965.
- Clark S. E. Commensal bacteria in the upper respiratory tract regulate susceptibility to infection / S. E. Clark // Current Opinion in Immunology. – 2020. – Vol. 66. – P. 42–46.
- Pathak J. L. The role of oral microbiome in respiratory health and diseases / J. L. Pathak, Y. Yan, Q. Zhang [et al.] // Respiratory Medicine. – 2021. – Vol. 185. – P. 106475.
- Zhao L. The Human Respiratory Microbiome: Current Understandings and Future Directions / L. Zhao, J. L. Luo, M. K. Ali [et al.] // American Journal of Respiratory Cell and Molecular Biology. – 2023. – Vol. 68, No 3. – P. 245–255.
- Man W. H. Loss of microbial topography between oral and nasopharyngeal microbiota and development of respiratory infections early in life / W. H. Man, M. Clerc, W. A. A. de Steenhuijsen Piters [et al.] // American Journal of Respiratory and Critical Care Medicine. – 2019. – Vol. 200. – P. 760–770.
- Whelan F. The loss of topography in the microbial communities of the upper respiratory tract in the elderly / F. Whelan, C. Verschoor, J. Stearns [et al.] // Annals of the American Thoracic Society. – 2014. – Vol. 11. – P. 513–521.
- Li R. Lung microbiome: new insights into the pathogenesis of respiratory diseases / R. Li, J. Li, X. Zhou // Signal Transduction and Targeted Therapy. – 2024. – Vol. 9, No 1. – P. 19.
- Baehren C. The Relevance of the Bacterial Microbiome, Archaeome and Mycobiome in Pediatric Asthma and Respiratory Disorders / C. Baehren, E. Buedding, A. Bellm [et al.] // Cells. – 2022. – Vol. 11, No 8. – P. 1287.
- Quinn-Bohmann N. Meta-analysis of the human upper respiratory tract microbiome reveals robust taxonomic associations with health and disease / N. Quinn-Bohmann, J. A. Freixas-Coutin, J. Seo [et al.] // BMC Biology. – 2024. – Vol. 22, No 1. – P. 93.
- Perdijk O. The microbiome: an integral player in immune homeostasis and inflammation in the respiratory tract / O. Perdijk, R. Azzoni, B. J. Marsland // Physiological Reviews. – 2024. – Vol. 104, No 2. – P. 835–879.
- Bang C. Archaea associated with human surfaces: Not to be underestimated / C. Bang, R. A. Schmitz // FEMS Microbiology Reviews. – 2015. – Vol. 39. – P. 631–648.
- Moryl M. Biofilm Formation and Motility of Proteus spp. Strains Isolated from Clinical Specimens / M. Moryl, U. Palatyńska, K. Dziubek [et al.] // Frontiers in Molecular Biosciences. – 2021. – Vol. 8. – P. 718222.
- Ward T. L. Development of the Human Mycobiome over the First Month of Life and across Body Sites / T. L. Ward, M. G. Dominguez-Bello, T. Heisel [et al.] // mSystems. – 2018. – Vol. 3, No 3. – P. e00140-17.
- Ghannoum M. A. Characterization of the Oral Fungal Microbiome (Mycobiome) in Healthy Individuals / M. A. Ghannoum, R. J. Jurevic, P. K. Mukherjee [et al.] // PLoS Pathogens. – 2010. – Vol. 6, No 1. – P. e1000713.
- Koskinen K. First Insights into the Diverse Human Archaeome: Specific Detection of Archaea in the Gastrointestinal Tract, Lung, and Nose and on Skin / K. Koskinen, M. R. Pausan, A. K. Perras [et al.] // mBio. – 2017. – Vol. 8, No 6. – P. e00824-17.
- Читать полезный контент о микрофлоре
- Смотреть видео лекции о восстановлении микрофлоры
- Купить препараты Велнес Биотика в нашем интернет магазине
- Купить препараты на Ozon
- Купить препараты на Wildberries